ویرایش ژنتیکی و تحولی بزرگ در درمان سرطان
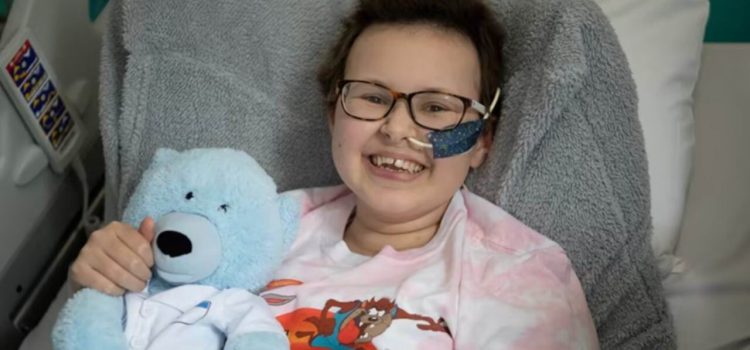
نوجوانی که سرطان خونش به درمانهای موجود جواب نداده بود با استفاده از یک روش نوین، اکنون عاری از سرطان است.
این روش مهندسی ژنتیک، نوعی «ویرایش ژنتیکی» دقیقتر است به نام «ویرایش بازهای نوکلئیدی» که به گفته پزشکان و دانشمندان بیمارستان گریت اورموند استریت در لندن، بیمارستان تخصصی کودکان دانشگاه یوسیال، برای اولین بار در دنیا انجام شده است و آلیسیا، دختر ۱۳ ساله، اکنون شش ماه بعد از شروع این درمان، عاری از سرطان است.
سال پیش پزشکان تشخیص دادند که آلیسیا به سرطان حاد لنفوسیتهای تی (T-ALL) مبتلا شده اما درمانهای رایج، شیمیدرمانی و پیوند مغز استخوان که معمولا موثرند، جواب ندادند. در این بیماری سلولهای تی که باید بدن را از عوامل بیماریزا محافظت کنند خود افسارگسیخته و بیماریزا میشوند.
بنابراین، متخصصان در بیمارستان گریت اوموند استریت به آلیسیا و مادرش پیشنهاد این روش جدید را دادند که برای کسی انجام نشده بود. راهی دیگری نمانده بود، آلیسیا در نهایت تصمیم گرفت آن را امتحان کند. او ۱۶ هفته در بخش ایزوله در بیمارستان بستری شد و حتی نمیتوانست برادرش را که مدرسه میرفت ببیند. در حین این درمان، چون سیستم ایمنی سرکوب میشود فرد بشدت در خطر عفونت قرار دارد.
یک گروه بزرگ علمی و طبی به سرپرستی پروفسور ایمنیشناسی واسیم قاسم شروع به آماده کردن دارو برای آلیسیا به روش جدید کردند. از زمانی که روش انقلابی ویرایش ژنتیکی موسوم به کریسپر معرفی شد حدود ده سال و از زمانی که روش جدیدتر ویرایش بازها معرفی شد شش سال میگذرد.
به گفته پروفسور قاسم این شاخه «بسرعت رو به پیشرفت» است و «قابلیت فراوانی» در درمان «بیماریهای مختلف» دارد.
آلیسیا وقتی فهمید موهایش با شیمیدرمانی خواهند ریخت تصمیم گرفت آنها را اهدا کند.
برای ساخت دارو، از یک فرد سالم لنفوسیتهای تی را گرفتند و با دستکاری ژنتیکی، آنها را به سلولهای تی موسوم به «کایمریک گیرنده آنتیژن» یا «سلول تی کار» تبدیل کردند.
این سلولهای «کار» دستکاری شدند تا سلولهای سرطانی را شناسایی و نابود کنند. اما استفاده از روش معمول تولید این سلولها برای درمان سرطان سلول تی آسان نیست، چرا که در مرحله تولید دارو، خود این سلولهای «کار» همدیگر را بجای سلول سرطانی میگیرند و از بین میبرند.
پژوهشگران در بیمارستان گریت اورموند استریت برای غلبه بر این مشکل از روش جدید ویرایش بازها استفاده کردند و چندین دستکاری در بازهای رشته دی ان آ کردند بجای اینکه خود رشته اصلی را ویرایش کنند.
اگر دو رشته دیانای را به شکل نردبان فرض کنیم، در روش کریسپر، برای دستکاری ژن معیوب بخشی از دو ستون نردبان هم دستکاری میشود، مثل شکل زیر:
اما در روش جدید یعنی ویرایش بازها فقط پلههای نردبان دستکاری میشوند، مثل شکل زیر:
دارو را به آلیسیا دادند و ۲۸ روز بعد، پیوند مغز استخوان کردند تا پس از اینکه سلولهای «کار» سلولهای سرطانی را از بین بردند، سیستم خونساز و ایمنی بتوانند بدون وجود سلولهای سرطانی، خود را نوسازی و بازسازی کنند.
تا سه ماه بعد آزمایشها نشان میدادند که سرطان هنوز باقی است. بعد اتفاق مهمی افتاد و در دو بررسی بعدی نشانی از سرطان در آلیسیا دیده نشد.
ویرایش بازهای نوکلئوتیدی: در بالا لنفوسیت تی که از اهداکننده سالم گرفته شده دیده میشود اما باید برای بیمار طراحی شود. ردیف دوم: ابتدا آن را برای مقاوم شدن به شیمیدرمانی دستکاری ژنتیکی میکنند کاری میکنند که سلولهای تی سالم به هم حمله نکنند و دستگاه ایمنی بیمار، سلولهای تی سالم را عامل خارجی شناسایی و به آنها حمله نکند. ردیف سوم: سلول تی دستکاری شده، به گیرندههای جدید مجهز میشود که اکنون قادر است سلولهای سرطانی را شناسایی و نابود کند.
اکنون سوال بزرگ این است که این وضعیت آیا پایدار میماند یا بیماری بر میگردد. از این رو آلیسیا مرتب از نظر طبی زیر نظر است با اینحال او که کریسمس پارسال ممکن بود آخرین کریسمسش باشد، اکنون با خوشحالی در کنار خانواده به روزهای بهتر امیدوار است.
سازمان غذا و داروی آمریکا به روش جدید اجازه کارآزمایی بالینی داده اما هنوز این روش برای درمان گسترده تایید نشده است.
بیمارستان گریت اورموند استریت کارآزمایی برای ده بیمار دیگر را که به درمانهای سرطان خون پاسح ندادهاند در برنامه دارد.
استفاده از ویرایش بازها برای بیماریهای دیگر هم مثل کمخونی داسی که فقط با تغییر یک باز در رشته دیانای قابل درماناند، بزودی انجام میشود.
تنها کارآزمایی بالینی دیگری که با استفاده از ویرایش بازها گزارش شده، تابستان ۲۰۲۲ در نیوزیلند بود، برای درمان یک بیماری ژنتیکی که باعث افزایش خطرناک کلسترول خون میشود.










آخرین دیدگاهها